Российские ученые определили 3D-структуру фермента для импортозамещения в сыроделии
13.03.2023
Коллектив исследователей с участием специалистов ЦКП "СКИФ" определил пространственную структуру рекомбинантного химозина алтайского марала. Исследование представляет интерес для российской пищевой промышленности: рекомбинантный химозин, необходимый в сыроделии для свертывания молока, в настоящее время не производится в России.
Для производства сыра в мире используются 2 типа химозина - натуральный и рекомбинантный или, другими словами, биотехнологический. Натуральный химозин - фермент, выделенный из желудков телят, постепенно уходит в прошлое, поскольку биотехнологии позволяют получить лучший результат более гуманным и дешевым способом. В настоящее время в России не производится отечественный рекомбинантный химозин, сыроделы используют импортную продукцию.
"Мировые исследования показали парадоксальный факт: рекомбинантный химозин верблюда обладает лучшими свойствами для свертывания коровьего молока, чем химозин коровы. С 2016 года мы ведем работы по созданию биотехнологических химозинов различных млекопитающих, поскольку рассчитываем найти самый эффективный химозин, а впоследствии - при помощи направленного дизайна - попытаться создать идеальный химозин, обладающий комплексом технологических свойств, важных для сыроделия", - рассказал ведущий научный сотрудник отдела биоинженерии ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора, к.б.н. Дмитрий Щербаков.
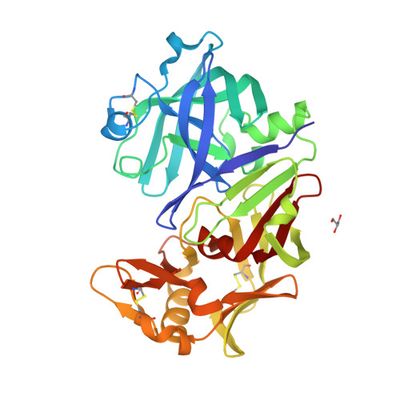
В рамках исследования коллектив получил рекомбинантные химозины алтайского марала и лося, сотрудники Алтайского государственного университета - наработали необходимое количество белка, сотрудники Новосибирского государственного университета (НГУ), ЦКП "Сибирский кольцевой источник фотонов" (ЦКП "СКИФ") и лаборатории перспективных исследований мембранных белков Московского физико-технического института (МФТИ) на базе МФТИ провели успешную кристаллизацию одного из химозинов (химозина марала). После этого сотрудники МФТИ удаленно провели эксперимент в Европейском центре синхротронного излучения (ESRF, Франция) и совместно со специалистами НГУ и ЦКП "СКИФ" расшифровали и уточнили эту структуру. Обработка данных велась в рамках Федеральной научно-технической программы развития синхротронных и нейтронных исследований и исследовательской инфраструктуры.
Кристаллическую структуру химозина марала можно найти в Protein Data Bank под кодовым номером 8CIK. Готовится статья, описывающая исследование и его результаты.
"3D-структуры рекомбинантных химозинов необходимы для изучения взаимосвязи структурного положения атомов и свойств белка. Прежде всего нас интересуют молокосвертывающая и протеолитическая активности, а также термостабильность. В будущем мы рассчитываем использовать возможности ЦКП «СКИФ», где планируется создать необходимую инфраструктуру - лабораторию кристаллизации белков и исследовательские станции, где будет реализован метод белковой кристаллографии. Благодаря этому мы сможем получить достаточное количество экспериментальных данных о различных химозинах и на этой основе создать модель работы фермента, а следовательно приблизимся к созданию идеального химозина", — комментирует Дмитрий Щербаков.
Сейчас для воссоздания модели работы рекомбинантного химозина используется компьютерное моделирование, его проводит теоретическая группа "Кванты и динамика".
"Химозины — это превосходные объекты для получения опыта и понимания типовых задач, с которыми встретятся исследователи биополимеров, которые приедут в ЦКП "СКИФ". Участвуя в подобных проектах сейчас, на этапе создании Центра, мы лучше понимаем, какие инфраструктурные и кадровые ресурсы необходимы для комфортной работы и какие компетенции должны быть у исследователей для определения пространственных структур биополимеров», - комментирует ответственный за направление "Структурная биология" ЦКП "СКИФ", старший научный сотрудник ЦКП "СКИФ", старший преподаватель кафедры химии твердого тела НГУ, к.х.н. Сергей Архипов.
Рекомбинантный химозин марала, созданный российским научным коллективом, показал хорошие результаты на практике и уже используется Сибирским научно-исследовательским институтом сыроделия для выработки сыров.